Soal Kimia Kelas XI pengertian dan Teori Asam Basa
Asam basa adalah konsep yang mengacu pada sifat keasaman atau basa (kealkalinan) suatu zat. Asam adalah zat yang dapat mengeluarkan ion hidrogen (H+) ketika terlarut dalam air, sedangkan basa adalah zat yang dapat mengeluarkan ion hidroksida (OH-) ketika terlarut dalam air.
Teori asam basa menyatakan bahwa asam dan basa memiliki sifat yang saling bertolak belakang. Asam memiliki sifat yang merusak dan dapat mengakibatkan iritasi pada kulit atau mata, sedangkan basa memiliki sifat yang menenangkan dan dapat mengakibatkan perasaan segar.
Asam dan basa dapat diukur dengan skala pH, yang menunjukkan tingkat keasaman atau kealkalinan suatu zat. Skala pH berkisar antara 0-14, di mana 0 adalah asam yang paling kuat, 7 adalah netral, dan 14 adalah basa yang paling kuat.
Asam dan basa dapat dibedakan berdasarkan reaksi yang terjadi ketika mereka bersentuhan. Jika asam dan basa bersentuhan, maka akan terjadi reaksi yang disebut neutralisasi, di mana asam dan basa akan saling membatalkan sifatnya dan menghasilkan garam dan air.
Soal 1
Basa adalah zat yang……..menurut Arhenius ?
Soal 2
Asam sulfat adalah salah satu asam yang sudah dikenal sejak lama. Menurut Arhenius,asam sulfat mempunyai sifat asam karena?
Soal 3
Perhatikan data berikut :
Larutan yang paling banyak mengandung ion OH- adalah ?
Soal 4
Asam konjugasi dari ion monohidrogen posphat HPO42- adalah ?
Soal 5
Basa konjugasi dari NH3 adalah ?
Soal 6
Dari reaksi : HCO3– + OH– → CO32- + H2O. Pasangan berikut yang disebut asam-basa Bronsted- Lowry adalah ?
Soal 7
Pasangan asam-basa konjugasi dari reaksi :
HSO4–(aq) + H2O(l) → H3O+(aq) + SO42-(aq) adalah ?
Soal 8
Senyawa HClO4 dapat bersifat asam maupun basa. Reaksi yang menunjukkan bahwa HClO4 bersifat basa adalah ?
Soal 9
Senyawa atau ion dibawah ini termasuk asam lewis adalah ?
A. NH3
B. F–
C. OH–
D. BF3
E. H2O
Soal 10
Basa menurut G.N. Lewis adalah ?
Soal 11
Berdasarkan reaksi diatas yang merupakan basa konjugasi adalah ?
Soal 12
Menurut Asam Basa Bronsted – Lowry reaksi yang menunjukkan H2O sebagai basa adalah ….
Soal 13
Asam konjugasi dari HPO4¬2- adalah ?
Soal 14
Berikut ini spesi yang bisa bertindak sebagai asam maupun basa menurut Bronsted-Lowry adalah ….
Soal 15
Perhatikan reaksi berikut ini :
Pernyataan yang benar tentang reaksi diatas adalah ?
Soal 16
Suatu indikator memberi warna merah dengan larutan kapur sirih. Indikator ini akan berwarna merah juga dalam ?
Soal 17
Siswa SMA Negeri I Karanganyar Kelas XI IPA mengukur pH air limbah industri pabrik- X dan pabrik-Y dengan menggunakan beberapa indikator, didapatkan data sebagai berikut ?
Air limbah-X dan Y mempunyai nilai pH berturut-turut…..
Soal 18
Seorang siswa telah menentukan pH air hujan di suatu daerah industri dengan menggunakan indika¬tor berikut ini. Data mengenai indikator adalah sebagai berikut :
Jika ternyata harga pH = 5,7, maka pasangan indikator yang telah digunakan adalah …….
Soal 19
Perhatikan data berikut :
Larutan yang paling banyak mengandung ion OH- adalah ….
Soal 20
Diketahui data trayek pH beberapa indicator :
Soal 21
Jenis indikator asam basa yang tepat digunakan pada titrasi larutan HCl oleh larutan NaOH adalah ?
Soal 22
Pada suhu 500C dan nilai Kw=10-12, pH larutan 0,01M KOH adalah ?
Soal 23
Besarnya pH larutan HCl yang konsentrasinya 1 x 10-9 M adalah ?
A.10,0
B.9,0
C.8,0
D.7,0
E.6,0
Soal 24
Berapa pH larutan yang dibuat dari 0,001 mol KOH dalam 10 liter air ?
Soal 25
Suatu obat baru yang diperoleh dari biji tanaman ternyata berupa basa organik yang lemah. Bila 0,010 M larutan obat tersebut dalam air mempunyai pH = 10, maka Kb obat tersebut adalah ?
Soal 26
Jika tetapan suatu asam HA adalah 10-5, pH larutan HA 0,1M adalah…….
Soal 27
Asam HA 0,1M jika ditetesi indikator univer¬sal akan memberikan warna yang sama jika HCl0,001 M ditetesi dengan indikator yang sama, maka harga Ka asam HA tersebut adalah ?
Soal 28
Jika larutan P mempunyai pH=5 dan larutan Q mempunyai pH=6, konsentrasi ion hidrogen dalam larutan P dan larutan Q berbanding sebagai ?
Soal 29
Jika larutan A memiliki ph 9 dan larutan B memiliki ph 11 maka perbandingan konsentrasi ion oH- dalam larutan A dan B adalah ?
Soal 30
4,9 gram H2SO4 dilarutkan dalam air hingga volume 2 liter, maka larutan tersebut akan mempunyai pH ?
Soal 31
200 ml larutan NaOH 0,4 M diencerkan dengan penambahan air hingga volume 500 ml.. maka pH larutan akan berubah dari ?
Soal 32
Suatu asam lemah HA memiliki tetapan dissosiasi 10-6. pH asam tersebut 4 maka konsentrasi asam HA tersebut adalah ?
Soal 33
100 ml Larutan NH3 0,1 M mempunyai pH = 11, maka larutan tersebut mempunyai tetapan dissosiasi sebesar ?
Soal 34
Suatu basa lemah LOH, memiliki pH = 9, jika konsentrasi basa tersebut 0,01 M Maka derajad dissosiasi basa tersebut adalah ?
Soal 35
Suatu basa lemah BOH 0,01 M terdissosiasi 1% maka harga pH larutan basa lemah tersebut adalah ?
Soal 36
Suatu asam lemah memiliki pH yang sama dengan H2SO4 5 x 10-5 M. Jika Ka dari asam lemah tersebut 1 x 10-5 Maka konsentrasi asam lemah tersebut adalah ?
Soal 37
200 ml larutan H2SO4 memiliki pH = 2 Maka jumlah gram NaOH padat (Mr=40) yang harus ditambahkan supaya pH menjadi 3 (perubahan volume akibat penambahan NaOH diabaikan) adalah ?
Soal 38
100 ml larutan HCl 0,2 M ditambah denagn 300 ml larutan KOH 0,1 M. Maka pH larutan yang dihasilkan adalah ?
Soal 39
Volume air yang harus di tambahkan ke dalam 100 ml larutan H2SO4 yang mempunyai pH 1 supaya menjadi ber pH 3 adalah ?
Soal 40
100 ml larutan NaOH 0,2 M direaksikan dengan 100 ml larutan H2SO4 0,1 M , Maka pH larutan yang terbentuk adalah ?
Soal 42
200 ml larutan Ba(OH)2 yang ber pH = 12 direaksikan dengan 800 ml larutan HCl yang ber pH 3 menghasilkan larutan yang ber pH ?
Soal 42
Perhatikan tabel Ka dari beberapa asam berikut:
No Nama Asam Ka
Berdasarkan tabel di atas, dapat ditarik kesimpulan bahwa kekuatan asam adalah ?
Soal 43
Larutan zat dibawah ini yang pH-nya paling besar adalah ?
Soal 44
Larutan berikut yang memiliki pH terkecil adalah ….(Ka = Kb = 10-5)
Soal 45
Dari faktor berikut :
Faktor yang menyebabkan kekuatan asam makin besar dengan bertambahnya ?
Soal 46
Tabel berikut memperlihatkan hubungan konsentrasi molar asam HA, asam HB,dan asam H2C dengan pH masing-masing zat. Molaritas pH HA pH HB pH H2C
Pernyataan berikut yang sesuai dengan data di atas adalah ?
Soal 47
Asam HX 0,1 M mengalatni ionisasi 1%, harga tetapan ionisasi HX adalah ?
Soal 48
Asam lemah HA 0,1M mengurai dalam air sebanyak 2%. Tetapan ionisasi asam lemah tersebut adalah ?
Soal 49
Larutan CH3COOH 0,1M yang terionisasi dengan derajat ionisasi 0,01 mempunyai pH sebesar ?
Soal 50
Suatu larutan yang bersifat asam mempunyai konsentrasi ion H+ adalah 0,02 M. Jika tetapan ionisasi asam adalah 10-6, maka asam tersebut terionisasi sebanyak ?
Soal 51
Untuk menetralkan 20 ml asam sulfat, diperlukan 20 ml NaOH 0,1M. Molaritas asam sulfat adalah..
Soal 52
Larutan 40 ml HCl 0,1M dicampur dengan 60 ml larutan NaOH 0,05M. Untuk menetralkan campuran ini dibutuhkan larutan Ca(OH)2 0,05M sebanyak ?
Soal 53
Sebanyak 20 ml larutan HCl dinetralkan dengan larutan NaOH 0,1M dan sebagai indikator digunakan penolptalein, ternyata perubahan indikator terjadi sesudah penambahan NaOH sebanyak 25 ml, maka kadar HCl dalam larutan adalah ?
Soal 54
Sebanyak 0,4 gram NaOH ( Ar Na=23, O=16,H=1) dilarutkan kedalam air, larutan yang terjadi akan dapat menetralkan larutan HCl 0,1M sebanyak ?
Soal 55
Perhatikan hasil titrasi larutan NaOH 0,1 M dengan larutan HCl 0,15 M berikut :
Netralisasi terjadi pada nomor ….
Soal 56
Data hasil titrasi antara larutan H2SO4 dengan larutan KOH 0,2M sebagai berikut :
Percobaan Vol.H2SO4 yang dititrasi Vol. KOH yg digunakan
Berdasarkan data tersebut, konsentrasi larutan H2SO4 adalah ?
Soal 57
Titrasi larutan HCl x M dengan larutan NaOH 0,1M. Siswa mengambil 10 ml larutan HCl x M dimasukkan erlenmeyer ditetesi 3 tetes indikator pp, dititrasi dengan NaOH 0,1M, pada saat terjadi perubahan warna menjadi merah muda, titik awal dan titik akhir ditulis pada data pengamatan sebagai berikut :
Percobaan titik awal titik akhir Vol. HCl
Pernyataan berikut merupakan contoh penggunaan konsep pH dalam lingkungan ?
Demikianlah artikel tentang Soal Kimia Kelas XI pengertian dan Teori Asam Basa, semoga bisa menjadi informasi yang bermanfaat untuk para pembaca setia blog pustaka ilmu. Jangan lupa untuk di share dan berkomentar. Terimakasih
Teori asam basa menyatakan bahwa asam dan basa memiliki sifat yang saling bertolak belakang. Asam memiliki sifat yang merusak dan dapat mengakibatkan iritasi pada kulit atau mata, sedangkan basa memiliki sifat yang menenangkan dan dapat mengakibatkan perasaan segar.
Asam dan basa dapat diukur dengan skala pH, yang menunjukkan tingkat keasaman atau kealkalinan suatu zat. Skala pH berkisar antara 0-14, di mana 0 adalah asam yang paling kuat, 7 adalah netral, dan 14 adalah basa yang paling kuat.
Asam dan basa dapat dibedakan berdasarkan reaksi yang terjadi ketika mereka bersentuhan. Jika asam dan basa bersentuhan, maka akan terjadi reaksi yang disebut neutralisasi, di mana asam dan basa akan saling membatalkan sifatnya dan menghasilkan garam dan air.
Soal 1
Basa adalah zat yang……..menurut Arhenius ?
- A. Mengubah warna lakmus merah menjadi biru
- B. Dengan penolpthalein warnanya menjadi merah
- C. Menerima proton dari suatu asam
- D. Menyebabkan luka bakar bila kena kulit
- E. Dalam air melepaskan OH–
Soal 2
Asam sulfat adalah salah satu asam yang sudah dikenal sejak lama. Menurut Arhenius,asam sulfat mempunyai sifat asam karena?
- A. Asam sulfat mengandung atom oksigen
- B. Asam sulfat mengandung atom hidrogen
- C. Asam sulfat dapat memberi proton kepada molekul air
- D. Asam sulfat dapat menerima pasangan elektron
- E. Asam sulfat dapat memperbesar konsentrasi ion H+ dalam air.
Soal 3
Perhatikan data berikut :
 |
| Soal 3 |
- A. 1 dan 5
- B. 1 dan 2
- C. 3 dan 4
- D. 4 dan 5
- E. 2, 3 dan 4
Soal 4
Asam konjugasi dari ion monohidrogen posphat HPO42- adalah ?
- A. H4PO4+
- B. H3PO4
- C. H2PO4–
- D. H2PO4
- E.PO43-
Soal 5
Basa konjugasi dari NH3 adalah ?
- A. NH4OH
- B. H2O
- C. NH2–
- D. NH2+
- E. OH–
Soal 6
Dari reaksi : HCO3– + OH– → CO32- + H2O. Pasangan berikut yang disebut asam-basa Bronsted- Lowry adalah ?
- A. HCO3– dan OH–
- B. HCO3– dan H2O
- C. OH– dan H2O
- D. OH– dan CO32-
- E. HCO3–,OH–,dan CO32-
Soal 7
Pasangan asam-basa konjugasi dari reaksi :
HSO4–(aq) + H2O(l) → H3O+(aq) + SO42-(aq) adalah ?
- A. HSO4–(aq) dan H2O(l)
- B. H3O+(aq) dan SO42-(aq)
- C. HSO4–(aq) dan H3O+(aq)
- D. H2O(l) dan SO42-(aq)
- E. HSO4–(aq) dan SO42-(aq)
Soal 8
Senyawa HClO4 dapat bersifat asam maupun basa. Reaksi yang menunjukkan bahwa HClO4 bersifat basa adalah ?
- A. HClO4 + NH2– ↔ ClO4– + NH3
- B. HClO4 + NH3 ↔ ClO4– + NH4+
- C. HClO4 + H2O ↔ ClO4– + H3O+
- D. HClO4 + OH– ↔ ClO4– + H2O
- E. HClO4 + N2H5+ ↔ H2ClO4+ + N2H4
Soal 9
Senyawa atau ion dibawah ini termasuk asam lewis adalah ?
A. NH3
B. F–
C. OH–
D. BF3
E. H2O
Soal 10
Basa menurut G.N. Lewis adalah ?
- A. Zat yang dapat menerima sepasang elektron.
- B. Zat yang dapat memberikan sepasang elektron.
- C. Zat yang dapat melepaskan ion OH– didalam air
- D. Zat yang dapat memberikan proton.
- E. Zat yang dapat menerima proton.
Soal 11
- CH3COOH + H2O ↔ H3O- + CH3COO-
Berdasarkan reaksi diatas yang merupakan basa konjugasi adalah ?
- A. CH3COOH dan CH3COO-
- B. H2O dan H3O-
- C. H3O- dan CH3COOH
- D. CH3COO- dan H2O
- E. CH3COO-
Soal 12
Menurut Asam Basa Bronsted – Lowry reaksi yang menunjukkan H2O sebagai basa adalah ….
- A. H2O + H2SO4 ↔ H3O+ + HSO4-
- B. H2O + CO22- ↔ HCO3- + OH-
- C. H2O + CO2 ↔ H2C O3
- D. H2O + NH3 ↔ NH4+ + OH-
- E. H2O + HSO4- ↔ OH- + H2SO4
Soal 13
Asam konjugasi dari HPO4¬2- adalah ?
- A. PO43-
- B. H3O¬+
- C. H3PO4
- D. H2PO4-
- E. P2O5
Soal 14
Berikut ini spesi yang bisa bertindak sebagai asam maupun basa menurut Bronsted-Lowry adalah ….
- A. H3O+ dan SO42-
- B. H2O dan S2-
- C. NH3 dan NH4+
- D. NH3 dan HSO42-
- E. NH4+ dan HSO42-
Soal 15
Perhatikan reaksi berikut ini :
- I. CO22- + H2O ↔ HCO3- + OH-
- II.H2CO3 + H2O ↔ HCO3- + H3O+
Pernyataan yang benar tentang reaksi diatas adalah ?
- A. HCO3- berlaku sebagai asam pada reaksi I dan basa pada reaksi II
- B. HCO3- berlaku sebagai basa pada reaksi I dan basa pada reaksi II
- C. HCO3- berlaku sebagai asam pada reaksi I dan asam pada reaksi II
- D. HCO3- berlaku sebagai basa pada reaksi I dan asam pada reaksi II
- E. HCO3- merupakan asam yang lebih kuat dari pada H2CO3
Soal 16
Suatu indikator memberi warna merah dengan larutan kapur sirih. Indikator ini akan berwarna merah juga dalam ?
- A. Air jeruk
- B. Air sabun
- C. Larutan cuka
- D. Larutan gula
- E. Larutan garam dapur.
Soal 17
Siswa SMA Negeri I Karanganyar Kelas XI IPA mengukur pH air limbah industri pabrik- X dan pabrik-Y dengan menggunakan beberapa indikator, didapatkan data sebagai berikut ?
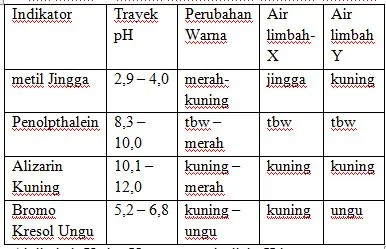 |
| Soal 17 |
- A. 123
- B. 234
- C. 345
- D. 543
- E. 145
Soal 18
Seorang siswa telah menentukan pH air hujan di suatu daerah industri dengan menggunakan indika¬tor berikut ini. Data mengenai indikator adalah sebagai berikut :
- Indikator Trayek pH Perubahan Warna
- metil Merah 2,9 – 4,0 merah-kuning
- Penolpthalein 8,3 – 10,0 tak berwarna – merah
- bromo tymol Blue 6,0 – 7,6 kuning – biru
- brom kresol hijau 3,8 – 5,4 kuning – biru
Jika ternyata harga pH = 5,7, maka pasangan indikator yang telah digunakan adalah …….
- A.Metil merah dengan brom kresol hijau
- B.Brom kresol hijau dengan bromo tymol blue
- C.Bromo tymol blue dengan penolptalein
- D.Metil merah dengan penolptalein
- E.Brom kresol hijau dengan penolptalein.
Soal 19
Perhatikan data berikut :
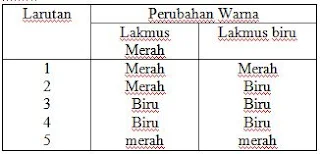 |
| Soal 19 |
- A.1 dan 5
- B.1 dan 2
- C.3 dan 4
- D.4 dan 5
- E.2, 3 dan 4
Soal 20
Diketahui data trayek pH beberapa indicator :
- Larutan Trayek pH Warna
- Brom timol biru 6,0 – 7,6 Kuning - Biru
- fenolftalein 8,2 – 10,0 Tak berwarna - Merah
- Metal merah 4,8 – 6,0 Merah - kuning
- Metil jingga 3,2 – 4,4 Merah - kuning
- A.5
- B.6
- C.7
- D.8
- E. 9
Soal 21
Jenis indikator asam basa yang tepat digunakan pada titrasi larutan HCl oleh larutan NaOH adalah ?
- A.Methyl Red
- B.Methyl Orange
- C.Bromo Tymol Blue
- D.Penolpthalein
- E.Curcumin.
Soal 22
Pada suhu 500C dan nilai Kw=10-12, pH larutan 0,01M KOH adalah ?
- A.1 + log 5
- B.2
- C.10
- D.12
- E.14
Soal 23
Besarnya pH larutan HCl yang konsentrasinya 1 x 10-9 M adalah ?
A.10,0
B.9,0
C.8,0
D.7,0
E.6,0
Soal 24
Berapa pH larutan yang dibuat dari 0,001 mol KOH dalam 10 liter air ?
- A.10
- B.12
- C.11
- D.7
- E.4
Soal 25
Suatu obat baru yang diperoleh dari biji tanaman ternyata berupa basa organik yang lemah. Bila 0,010 M larutan obat tersebut dalam air mempunyai pH = 10, maka Kb obat tersebut adalah ?
- A.10-
- B.10-3
- C.10-4
- D.10-5
- E. 10-6
Soal 26
Jika tetapan suatu asam HA adalah 10-5, pH larutan HA 0,1M adalah…….
- A.5
- B.4
- C.3
- D.2
- E.1
Soal 27
Asam HA 0,1M jika ditetesi indikator univer¬sal akan memberikan warna yang sama jika HCl0,001 M ditetesi dengan indikator yang sama, maka harga Ka asam HA tersebut adalah ?
- A. 1 x 10-5
- B. 1 x 10-6
- C. 2 x 10-6
- D. 4 x 10-7
- E. 2 x 10-6
Soal 28
Jika larutan P mempunyai pH=5 dan larutan Q mempunyai pH=6, konsentrasi ion hidrogen dalam larutan P dan larutan Q berbanding sebagai ?
- A. 1 : 0,1
- B. 1 : 2
- C. 1 : 10
- D. 5 : 6
- E. Log 5 : log 6
Soal 29
Jika larutan A memiliki ph 9 dan larutan B memiliki ph 11 maka perbandingan konsentrasi ion oH- dalam larutan A dan B adalah ?
- A. 1 : 1
- B. 1: 10
- C. 1 : 100
- D. 10 : 1
- E. 100 : 1
Soal 30
4,9 gram H2SO4 dilarutkan dalam air hingga volume 2 liter, maka larutan tersebut akan mempunyai pH ?
- A. 4
- B. 4 – log 5
- C. 4 – log 2,5
- D. 5 – log 4
- E. 10 + log 5
Soal 31
200 ml larutan NaOH 0,4 M diencerkan dengan penambahan air hingga volume 500 ml.. maka pH larutan akan berubah dari ?
- A. 1 – log 4 menjadi 2 – log 1,6
- B. 4 – log 1 menjadi 1,6 – log 2
- C. 1 3 – log 4 menjadi 12 – log 1,6
- D. 13 menjadi 12 – log 1,6
- E. 13 + log 4 menjadi 2 + log 1,6
Soal 32
Suatu asam lemah HA memiliki tetapan dissosiasi 10-6. pH asam tersebut 4 maka konsentrasi asam HA tersebut adalah ?
- A. 0,001M
- B. 0,01M
- C. 0,1M
- D. 1M
- E. 2M
Soal 33
100 ml Larutan NH3 0,1 M mempunyai pH = 11, maka larutan tersebut mempunyai tetapan dissosiasi sebesar ?
- A. 10-7
- B. 10-6
- C. 10-5
- D. 10-4
- E. 10-3
Soal 34
Suatu basa lemah LOH, memiliki pH = 9, jika konsentrasi basa tersebut 0,01 M Maka derajad dissosiasi basa tersebut adalah ?
- A. 0.0001
- B. 0.001
- C. 0,01
- D. 0,1
- E. 1
Soal 35
Suatu basa lemah BOH 0,01 M terdissosiasi 1% maka harga pH larutan basa lemah tersebut adalah ?
- A. 4
- B. 5
- C. 7
- D. 10
- E. 12
Soal 36
Suatu asam lemah memiliki pH yang sama dengan H2SO4 5 x 10-5 M. Jika Ka dari asam lemah tersebut 1 x 10-5 Maka konsentrasi asam lemah tersebut adalah ?
- A. 0,0001M
- B. 0,001M
- C. 0,01M
- D. 0,1M
- E. 1M
Soal 37
200 ml larutan H2SO4 memiliki pH = 2 Maka jumlah gram NaOH padat (Mr=40) yang harus ditambahkan supaya pH menjadi 3 (perubahan volume akibat penambahan NaOH diabaikan) adalah ?
- A. 1,8x10-4 gram
- B. 9 x 10-4 gram
- C. 1,8 x 10-3 gram
- D. 7,2 x 10-3 gram
- E. 9 x 10-3 gram
Soal 38
100 ml larutan HCl 0,2 M ditambah denagn 300 ml larutan KOH 0,1 M. Maka pH larutan yang dihasilkan adalah ?
- A. 2 – log 2
- B. 4 – log 2
- C. 12 – log 2
- D. 10 + log 2
- E. 12 + log 2
Soal 39
Volume air yang harus di tambahkan ke dalam 100 ml larutan H2SO4 yang mempunyai pH 1 supaya menjadi ber pH 3 adalah ?
- A. 1 liter
- B. 5 liter
- C. 9 liter
- D. 9,9 liter
- E. 10 liter
Soal 40
100 ml larutan NaOH 0,2 M direaksikan dengan 100 ml larutan H2SO4 0,1 M , Maka pH larutan yang terbentuk adalah ?
- A. 1
- B. 3
- C. 5
- D. 7
- E. 9
Soal 42
200 ml larutan Ba(OH)2 yang ber pH = 12 direaksikan dengan 800 ml larutan HCl yang ber pH 3 menghasilkan larutan yang ber pH ?
- A. 6 – log 2
- B. 6
- C. 8 – log 2
- D. 6 + log 2
- E. 8 + log 2
Soal 42
Perhatikan tabel Ka dari beberapa asam berikut:
No Nama Asam Ka
- HA 6,2 x 10-8
- HB 7,5 x 10-2
- HC 1,2 x 10-2
- HD 1,8 x 10-12
- HE 1,8 x 10-5
- HG 7 x 10-4
- HK 6,7 x 10-5
- HL 9,6 x 10-7
Berdasarkan tabel di atas, dapat ditarik kesimpulan bahwa kekuatan asam adalah ?
- A. HL > HE > HB
- B. HB < HE < HD
- C. HL < HK < HC
- D. HA > HG > HC
- E. HB < HL < HD
Soal 43
Larutan zat dibawah ini yang pH-nya paling besar adalah ?
- A. 0,01M HCl
- B. 0,01M H2SO4
- C. 0,01M CH3COOH ( Ka = 10-5)
- D. 0,01M HNO3
- E. 0,01M NH3 (Kb= 10-6)
Soal 44
Larutan berikut yang memiliki pH terkecil adalah ….(Ka = Kb = 10-5)
- A. 20 ml larutan HCl 0,4M
- B. 40 ml larutan NH4OH 0,4M
- C. 20 ml larutan H2SO4 0,4M
- D. 30 ml larutan CH3COOH 0,4M
- E. 10 ml larutan KOH 0,4M
Soal 45
Dari faktor berikut :
- i. Ka
- ii. pH
- iii. Kb
- iv. Kw
Faktor yang menyebabkan kekuatan asam makin besar dengan bertambahnya ?
- A. i dan ii
- B. i dan iii
- C. ii dan iii
- D. ii dan iv
- E. iii dan iv
Soal 46
Tabel berikut memperlihatkan hubungan konsentrasi molar asam HA, asam HB,dan asam H2C dengan pH masing-masing zat. Molaritas pH HA pH HB pH H2C
- 0,01M 2,0 3,5 5,0
- 0,001M 3,0 4,0 5,5
- 0,0001M 4,0 4,5 6
Pernyataan berikut yang sesuai dengan data di atas adalah ?
- A. Urutan kekuatan asam H2C > HB > HA
- B. H2C lebih kuat dari HA karena dapat melepas 2 mol H+ tiap molnya
- C. Ka H2C > Ka HB
- D. Untuk konsentrasi yang sama, semakin kecil pH maka makin kuat asamnya.
- E. Dapat dipastikan harga pKa dari asam HA adalah 1.
Soal 47
Asam HX 0,1 M mengalatni ionisasi 1%, harga tetapan ionisasi HX adalah ?
- A. 2 x 10-5 M
- B. 1 x 10-5 M
- C. 1 x 10-4 M
- D. 1 x 10-2 M
- E. 2 x 10-6 M
Soal 48
Asam lemah HA 0,1M mengurai dalam air sebanyak 2%. Tetapan ionisasi asam lemah tersebut adalah ?
- A. 2 x 10-3
- B. 4 x 10-3
- C. 2 x 10-4
- D. 4 x 10-4
- E. 4 x 10-5
Soal 49
Larutan CH3COOH 0,1M yang terionisasi dengan derajat ionisasi 0,01 mempunyai pH sebesar ?
- A. 1
- B. 2
- C. 3
- D. 4
- E. 5
Soal 50
Suatu larutan yang bersifat asam mempunyai konsentrasi ion H+ adalah 0,02 M. Jika tetapan ionisasi asam adalah 10-6, maka asam tersebut terionisasi sebanyak ?
- A. 5%
- B. 4%
- C. 3%
- D. 2%
- E. 1%
Soal 51
Untuk menetralkan 20 ml asam sulfat, diperlukan 20 ml NaOH 0,1M. Molaritas asam sulfat adalah..
- A. 1,00 M
- B. 0,50 M
- C. 0,20 M
- D. 0,15 M
- E. 0,05 M
Soal 52
Larutan 40 ml HCl 0,1M dicampur dengan 60 ml larutan NaOH 0,05M. Untuk menetralkan campuran ini dibutuhkan larutan Ca(OH)2 0,05M sebanyak ?
- A. 2 ml
- B. 5 ml
- C. 10 ml
- D. 15 ml
- E. 20 ml
Soal 53
Sebanyak 20 ml larutan HCl dinetralkan dengan larutan NaOH 0,1M dan sebagai indikator digunakan penolptalein, ternyata perubahan indikator terjadi sesudah penambahan NaOH sebanyak 25 ml, maka kadar HCl dalam larutan adalah ?
- A. 0,06 M
- B. 0,08 M
- C. 0,10 M
- D. 0,12 M
- E. 0,15 M
Soal 54
Sebanyak 0,4 gram NaOH ( Ar Na=23, O=16,H=1) dilarutkan kedalam air, larutan yang terjadi akan dapat menetralkan larutan HCl 0,1M sebanyak ?
- A. 10 ml
- B. 20 ml
- C. 50 ml
- D. 100 ml
- E. 110 ml
Soal 55
Perhatikan hasil titrasi larutan NaOH 0,1 M dengan larutan HCl 0,15 M berikut :
 |
| Soal 55 |
- A. 1
- B. 2
- C. 3
- D. 4
- E. 5
Soal 56
Data hasil titrasi antara larutan H2SO4 dengan larutan KOH 0,2M sebagai berikut :
Percobaan Vol.H2SO4 yang dititrasi Vol. KOH yg digunakan
- 1 30 ml 15 ml
- 2 30 ml 17 ml
- 3 30 ml 13 ml
Berdasarkan data tersebut, konsentrasi larutan H2SO4 adalah ?
- A. 0,05 M
- B. 0,10 M
- C. 0,15 M
- D. 0,20 M
- E. 0,25 M
Soal 57
Titrasi larutan HCl x M dengan larutan NaOH 0,1M. Siswa mengambil 10 ml larutan HCl x M dimasukkan erlenmeyer ditetesi 3 tetes indikator pp, dititrasi dengan NaOH 0,1M, pada saat terjadi perubahan warna menjadi merah muda, titik awal dan titik akhir ditulis pada data pengamatan sebagai berikut :
Percobaan titik awal titik akhir Vol. HCl
- 1 0 12 10 ml
- 2 12 21 10 ml
- 3 21 30 10 ml
- A. 0,5
- B. 0,4
- C. 0,3
- D. 0,2
- E. 0,1
Pernyataan berikut merupakan contoh penggunaan konsep pH dalam lingkungan ?
- A. Penentuan standar kualitas air kolam
- B. Penentuan standar kualitas udara
- C. Penentuan standar kualitas bensin
- D. Pelapisan logam dengan logam lain
- E. Penggunaan aki pada kendaraan bermotor
Demikianlah artikel tentang Soal Kimia Kelas XI pengertian dan Teori Asam Basa, semoga bisa menjadi informasi yang bermanfaat untuk para pembaca setia blog pustaka ilmu. Jangan lupa untuk di share dan berkomentar. Terimakasih

Post a Comment for "Soal Kimia Kelas XI pengertian dan Teori Asam Basa"
Post a Comment