Materi Kimia Kelas 11 Mengenai Termokimia 1
Termokimia adalah cabang kimia yang mempelajari tentang hubungan antara energi termal dan reaksi kimia. Termokimia mempelajari bagaimana reaksi kimia dapat mengeluarkan atau menyerap energi termal, serta bagaimana energi termal tersebut dapat digunakan untuk menghitung entalpi reaksi, yaitu perubahan entalpi yang terjadi selama reaksi kimia.
Dasar-dasar termokimia dapat diaplikasikan untuk menghitung kalor yang terlibat dalam reaksi kimia, mengukur energi yang terkandung dalam bahan bakar, dan menghitung energi yang diperlukan untuk mengalirkan listrik melalui suatu sistem.
Termokimia juga dapat membantu menjelaskan bagaimana reaksi kimia dapat mempengaruhi suhu. Misalnya, jika suatu reaksi kimia mengeluarkan kalor, maka suhu akan meningkat. Sebaliknya, jika reaksi kimia menyerap kalor, maka suhu akan menurun.
Untuk mempelajari termokimia, biasanya diperlukan pengetahuan dasar tentang kimia, termodinamika, dan matematika. Termokimia sangat penting dalam berbagai bidang, seperti teknik mesin, teknik kimia, dan teknik energi.
Istilah Termokimia
Sistem dan Lingkungan
Sistem adalah bagian tertentu dari alam yang menjadi pusat untuk dipelajari. Sedangkan lingkungan adalah segala sesuatu yang berada di luar sistem. Misalkan kita mempelajari reaksi kimia, contohkan saja reaksi logam dengan asam dalam tabung reaksi. Yang menjadi sitem dalam hal ini adalah reaksi antara logam dengan asam, sedangkan lingkungan adalah tabung reaksi dan udara yang berada di sekitar sistem. Antara sistem dan lingkungan meliliki batas. Ada yang bersifat diatermal (tembus energi) atau adiatermal (tidak tembus energi). akibatnya sistem itu terdiri dari tiga macam, yaitu sistem terbuka, tertutup dan terisolasi.
Sistem terbuka adalah sistem yang memungkinkan adanya pertukaran energi dan materi dari sistem ke lingkungan
Contoh :
Air panas dalam gelas yang terbuka, jika kita biarkan maka energi panas dalam air akan mengalir ke udara sehingga lama kelamaan air dalam gelas akan menjadi dingin. Hal ini menandakan adanya pertukaran energi dari sistem (air) ke lingkungan (gelas dan udara). Jika kita biarkan lebih lama maka air akan menguapa ke udara sehingga julahnya jadi lebih sedikit. Artinya ada perpindahan materi dari sistem ke lingkungan.
Sistem tertutup adalah sistem yang mempunyai didning diatermal sehingga hanya terjadi pertukaran energi saja.
Contoh :
air panas dalam gelas yang tertutup rapat. Gelas adalah dinding diatermalnya sehingga ketika air panas dalam gelas yang tertutup rapat ini kita biarkan maka lama kelamaan suhu airnya juga akan turun tetapi jumlah air tidak berkurang karena sistemnya tertutup oleh dinding diatermalnya.
Sistem terisolasi adalah sietem yang tidak memungkinkan terjadinya pertukaran energi dan materi dari sistem ke lingkungan.
Contoh :
Air panas dalam termos. Termos dibuat menggunakan prinsip dinding adiatermal sehingga mampu menjaga suhu air dan jumlahnya realtif tetap.
Kalor dan Kerja
Kerja (w)
Jika sebuah pompa kita isi gas yang memiliki tekanan dalam lebih besar dari tekanan udara luar, maka akan terjadi pergerakan piston sampai tekanan keduanya sama. Pergerakan ini akan mengakibatkan adanya perubahan volume sistem. Perpindahan piston itu membutuhkan energi yang disebut dengan kerja volume. Nilai ini bergantung pada besarnya perubahan volume dan tekanan udara, sehingga dapat ditulis secara matematis:
w = P (∆V)
w = P (V2 – V1)
Keterangan :
w = kerja (L atm)
P = Tekanan Udara luar
V1 = Volume awal sistem
V2 = Volume akhir sistem
Kalor (q)
Kalor adalah energi mekanik akibat gerakan partikel materi dan dapat berpindah dari suatu tempat ke tempat yang lain. Jika suatu sistem mempunyai didning diatermal yang suhu sistemnya lebih besar dari suhu linkungan maka akan terjadi perpindahan energi dari sistem ke lingkungan.Hal ini juga berlaku sebaliknya. Perpindahan kalor dapat terjadi secara konveksi, radiasi atau konduksi.
Hukum Termodinamika 1
Energi dalam (U)
Energi dalam itu tidak dapat dicari nilai mutlaknya. Kenapa??? mari kita perhatikan penjelasan berikut :
Setiap materi dalam sistem mempunyai sejumlah tertentu energi. Sebagai contoh adalah bensin yang energi didalamnya dapat digunakan untuk bahan bakar kendaraan bermotor. Energi yang dimiliki oleh suatu zat terdiri dari energi kinetik dan energi potensial. Energi kinetik adalah energi yang berkaitan dengan gerakan molekul molekul sistem, sedangkan energi dalam bentuk lain selain energi gerak kita golongkan ke dalam energi potensial. Gerakan partikel dapat berupa gerakan translasi (berpindah tempat) rotasi (berputar ) atau vibrasi (bergetar).
Dasar-dasar termokimia dapat diaplikasikan untuk menghitung kalor yang terlibat dalam reaksi kimia, mengukur energi yang terkandung dalam bahan bakar, dan menghitung energi yang diperlukan untuk mengalirkan listrik melalui suatu sistem.
Termokimia juga dapat membantu menjelaskan bagaimana reaksi kimia dapat mempengaruhi suhu. Misalnya, jika suatu reaksi kimia mengeluarkan kalor, maka suhu akan meningkat. Sebaliknya, jika reaksi kimia menyerap kalor, maka suhu akan menurun.
Untuk mempelajari termokimia, biasanya diperlukan pengetahuan dasar tentang kimia, termodinamika, dan matematika. Termokimia sangat penting dalam berbagai bidang, seperti teknik mesin, teknik kimia, dan teknik energi.
Istilah Termokimia
Sistem dan Lingkungan
Sistem adalah bagian tertentu dari alam yang menjadi pusat untuk dipelajari. Sedangkan lingkungan adalah segala sesuatu yang berada di luar sistem. Misalkan kita mempelajari reaksi kimia, contohkan saja reaksi logam dengan asam dalam tabung reaksi. Yang menjadi sitem dalam hal ini adalah reaksi antara logam dengan asam, sedangkan lingkungan adalah tabung reaksi dan udara yang berada di sekitar sistem. Antara sistem dan lingkungan meliliki batas. Ada yang bersifat diatermal (tembus energi) atau adiatermal (tidak tembus energi). akibatnya sistem itu terdiri dari tiga macam, yaitu sistem terbuka, tertutup dan terisolasi.
Sistem terbuka adalah sistem yang memungkinkan adanya pertukaran energi dan materi dari sistem ke lingkungan
Contoh :
Air panas dalam gelas yang terbuka, jika kita biarkan maka energi panas dalam air akan mengalir ke udara sehingga lama kelamaan air dalam gelas akan menjadi dingin. Hal ini menandakan adanya pertukaran energi dari sistem (air) ke lingkungan (gelas dan udara). Jika kita biarkan lebih lama maka air akan menguapa ke udara sehingga julahnya jadi lebih sedikit. Artinya ada perpindahan materi dari sistem ke lingkungan.
Sistem tertutup adalah sistem yang mempunyai didning diatermal sehingga hanya terjadi pertukaran energi saja.
 |
| didning diatermal |
air panas dalam gelas yang tertutup rapat. Gelas adalah dinding diatermalnya sehingga ketika air panas dalam gelas yang tertutup rapat ini kita biarkan maka lama kelamaan suhu airnya juga akan turun tetapi jumlah air tidak berkurang karena sistemnya tertutup oleh dinding diatermalnya.
Sistem terisolasi adalah sietem yang tidak memungkinkan terjadinya pertukaran energi dan materi dari sistem ke lingkungan.
 |
| pertukaran energi |
Air panas dalam termos. Termos dibuat menggunakan prinsip dinding adiatermal sehingga mampu menjaga suhu air dan jumlahnya realtif tetap.
Kalor dan Kerja
Kerja (w)
 |
| Kalor dan Kerja |
w = P (∆V)
w = P (V2 – V1)
Keterangan :
w = kerja (L atm)
P = Tekanan Udara luar
V1 = Volume awal sistem
V2 = Volume akhir sistem
Kalor (q)
Kalor adalah energi mekanik akibat gerakan partikel materi dan dapat berpindah dari suatu tempat ke tempat yang lain. Jika suatu sistem mempunyai didning diatermal yang suhu sistemnya lebih besar dari suhu linkungan maka akan terjadi perpindahan energi dari sistem ke lingkungan.Hal ini juga berlaku sebaliknya. Perpindahan kalor dapat terjadi secara konveksi, radiasi atau konduksi.
Hukum Termodinamika 1
Energi dalam (U)
Energi dalam itu tidak dapat dicari nilai mutlaknya. Kenapa??? mari kita perhatikan penjelasan berikut :
Setiap materi dalam sistem mempunyai sejumlah tertentu energi. Sebagai contoh adalah bensin yang energi didalamnya dapat digunakan untuk bahan bakar kendaraan bermotor. Energi yang dimiliki oleh suatu zat terdiri dari energi kinetik dan energi potensial. Energi kinetik adalah energi yang berkaitan dengan gerakan molekul molekul sistem, sedangkan energi dalam bentuk lain selain energi gerak kita golongkan ke dalam energi potensial. Gerakan partikel dapat berupa gerakan translasi (berpindah tempat) rotasi (berputar ) atau vibrasi (bergetar).
Setiap gerakan partikel dipengaruhi oleh banyak faktor dan dapat berubah bentuk jika partikel saling bertumbukkan. Akibatnya besar energi gerakan suatu partikel akan berbeda dengan partikel lainnya. Jumlah total energi itulah yang disebut dengan energi dalam. Karena hal inilah jumlah energi dalam suatu sistem tidak dapat ditentukan nilai mutlaknya.
Apa yang dapat kita ukur dari energi dalam adalah perubahannya. yaitu selisih antara energi energi produk dan energi pereaksi.
∆U = Uproduk - Urekatan
Rumusan Hukum Termodinamika
Misalkan suatu gas dalam pompa dipanaskan, maka suhu gas dalam pompa itu akan meningkat. Artinya, sistem telah menerima sejumlah energi. Jika diberi energi, maka sistem akan bekerja dengan menolak dinding - dinding pompa. Dengan kata lain kalor(q) yang diberikan sistem sebagian disimpan dalam bentuk energi dalam dan sebagian digunakan untuk melakukan kerja. Rumusan inilah yang menjadi dasar dari hukum termodinamika dan secara matematika dituIis :
q = ∆U – w
dan dapat dinyatakan dengan kata - kata :
"Energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat diubah dari satu bentuk ke bentuk lainnya."
atau
"Energi yang dimiliki oleh alam semesta itu konstan"
Karena itu hukum termodinamika 1 sering disebut dengan hukum kekekalan energi.
Tanda Untuk Kalor dan Kerja
Agar tidak keliru dalam menggunakan rumus Hukum 1 termodinamika maka ditetapkanlah suatu perjanjian tentang tanda w dan q.
Tanda untuk kalor dan kerja ditetapkan sebagai berikut:
Kalor reaksi
Oke sekarang marilah kita pelajari kaitan energi dalam pereaksi dengan dengan energi dalam produknya.
Perubahan enegri dalam yang menyertai reaksi adalah :
∆U = Uproduk - Urekatan
Perubahan energi dalam tersebut akan muncul sebagai kalor atau kerja yang dilakukan oleh sistem.
∆U = q (kalor reaksi) + w (kerja)
Dalam hal ini q kita sebut kalor reaksi
Dalam kehidupan sehari - hari, dapat kita lihat bahwa kebanyakan reaksi berlangsung pada keadaan dimana tekanan udara sistem sama dengan tekanan udara luar (tekanan tetap), sehingga dalam hal ini tidak akan terjadi kerja volume yaitu kerja yang menyebabkan terjadinya perubahan volume sistem. Jika perubahan voumenya = 0, maka kerja yang dilakukan sistem pada keadaan ini tentu juga 0. Maka rumus energi dalam menjadi :
Dapat dilihat dari persamaan tersebut bahwa perubahan energi dalam yang meyertai suatu reaksi akan muncul sebagai kalor yang dilepaskan atau diserap oleh sistem. Kalor reaksi yang berlngsung pada tekanan tetap inilah yang disebut dengan istilah perubahan entalpi reaksi yang diberi lambang ∆H.
∆H = q reaksi
∆H = Hp - Hr
Hp = entalpi produk
Hr = entalpi reaktan
Reaksi eksoterm dan endoterm
Reaksi Eksoterm : Kalor mengalir dari sistem ke lingkungan
Pada reaksi endoterm sistem akan menyerap energi. Oleh karena itu entalpi sistem akan bertambah, artinya entalpi produk (Hp) lebih besar dari entalpi pereaksi (Hr). Akibatnya perubahan entalpi (∆H) , yaitu selisih antara entalpi produk dan entalpi reaktan akan bertanda positif
Reaksi endoterm : ∆H = Hp - Hr > 0 = +
Diagram tingkat energi
Reaksi Endoterm : Kalor mengalir dari lingkungan ke sistem
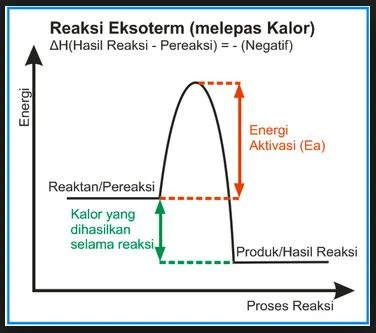
Pada reaksi eksoterm, sistem akan membebaskan energi sehingga entalpi sistem berkurang. Artinya entalpi produk lebih kecil dibandingkan dengan entalpi pereaksi sehingga harga perubahan entalpinya (∆H) bertanda negatif.
Reaksi eksoterm : ∆H = Hp - Hr < 0 = -
Diagram tingkat energi
Demikianlah artikel tentang Materi Kimia Kelas 11 Mengenai Termokimia 1 , semoga bisa menjadi informasi yang bermanfaat untuk para pembaca setia blog pustaka ilmu. Jangan lupa untuk di share dan berkomentar. Terimakasih
Apa yang dapat kita ukur dari energi dalam adalah perubahannya. yaitu selisih antara energi energi produk dan energi pereaksi.
∆U = Uproduk - Urekatan
Rumusan Hukum Termodinamika
Misalkan suatu gas dalam pompa dipanaskan, maka suhu gas dalam pompa itu akan meningkat. Artinya, sistem telah menerima sejumlah energi. Jika diberi energi, maka sistem akan bekerja dengan menolak dinding - dinding pompa. Dengan kata lain kalor(q) yang diberikan sistem sebagian disimpan dalam bentuk energi dalam dan sebagian digunakan untuk melakukan kerja. Rumusan inilah yang menjadi dasar dari hukum termodinamika dan secara matematika dituIis :
q = ∆U – w
dan dapat dinyatakan dengan kata - kata :
"Energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat diubah dari satu bentuk ke bentuk lainnya."
atau
"Energi yang dimiliki oleh alam semesta itu konstan"
Karena itu hukum termodinamika 1 sering disebut dengan hukum kekekalan energi.
Tanda Untuk Kalor dan Kerja
 |
| Tanda Untuk Kalor dan Kerja |
Tanda untuk kalor dan kerja ditetapkan sebagai berikut:
- Sistem menerima kalor q bertanda positifi (+)
- Sistem membebaskan kalor , q bertanda negatif (-)
- Sistem melakukan kerja , w bertnada negatif (-)
- Sistem menerima kerja, w bertanda positif (+)
Kalor reaksi
Oke sekarang marilah kita pelajari kaitan energi dalam pereaksi dengan dengan energi dalam produknya.
Perubahan enegri dalam yang menyertai reaksi adalah :
∆U = Uproduk - Urekatan
Perubahan energi dalam tersebut akan muncul sebagai kalor atau kerja yang dilakukan oleh sistem.
∆U = q (kalor reaksi) + w (kerja)
Dalam hal ini q kita sebut kalor reaksi
Dalam kehidupan sehari - hari, dapat kita lihat bahwa kebanyakan reaksi berlangsung pada keadaan dimana tekanan udara sistem sama dengan tekanan udara luar (tekanan tetap), sehingga dalam hal ini tidak akan terjadi kerja volume yaitu kerja yang menyebabkan terjadinya perubahan volume sistem. Jika perubahan voumenya = 0, maka kerja yang dilakukan sistem pada keadaan ini tentu juga 0. Maka rumus energi dalam menjadi :
Dapat dilihat dari persamaan tersebut bahwa perubahan energi dalam yang meyertai suatu reaksi akan muncul sebagai kalor yang dilepaskan atau diserap oleh sistem. Kalor reaksi yang berlngsung pada tekanan tetap inilah yang disebut dengan istilah perubahan entalpi reaksi yang diberi lambang ∆H.
∆H = q reaksi
∆H = Hp - Hr
Hp = entalpi produk
Hr = entalpi reaktan
Reaksi eksoterm dan endoterm
 |
| Reaksi eksoterm dan endoterm |
Pada reaksi endoterm sistem akan menyerap energi. Oleh karena itu entalpi sistem akan bertambah, artinya entalpi produk (Hp) lebih besar dari entalpi pereaksi (Hr). Akibatnya perubahan entalpi (∆H) , yaitu selisih antara entalpi produk dan entalpi reaktan akan bertanda positif
Reaksi endoterm : ∆H = Hp - Hr > 0 = +
Diagram tingkat energi
 |
| Reaksi Endoterm |
Pada reaksi eksoterm, sistem akan membebaskan energi sehingga entalpi sistem berkurang. Artinya entalpi produk lebih kecil dibandingkan dengan entalpi pereaksi sehingga harga perubahan entalpinya (∆H) bertanda negatif.
Reaksi eksoterm : ∆H = Hp - Hr < 0 = -
Diagram tingkat energi
 |
| Diagram tingkat energi |

Post a Comment for "Materi Kimia Kelas 11 Mengenai Termokimia 1 "
Post a Comment