Soal Latihan Asam Basa dan Hasil Kali Kelarutan 2
Asam basa adalah konsep yang mengacu pada sifat reaksi suatu zat dengan air. Zat yang dapat mengalami reaksi dengan air disebut zat terlarut. Asam adalah zat terlarut yang dapat mengeluarkan ion hidrogen (H+) saat bereaksi dengan air, sedangkan basa adalah zat terlarut yang dapat mengeluarkan ion hidroksil (OH-) saat bereaksi dengan air.
Kali kelarutan adalah ukuran kelarutan suatu zat dalam air pada suhu kamar. Nilai kali kelarutan dapat berkisar dari 0 (tidak larut) hingga bila-bila (larut dalam jumlah tak terbatas). Nilai kali kelarutan yang tinggi menunjukkan bahwa suatu zat dapat larut dalam jumlah yang lebih besar dalam air.
Contoh zat yang bersifat asam adalah asam asetat, asam klorida, dan asam sulfat. Contoh zat yang bersifat basa adalah natrium hidroksida, kalium hidroksida, dan kalsium hidroksida.
Kali kelarutan merupakan salah satu faktor yang mempengaruhi reaksi asam-basa. Zat dengan kali kelarutan yang tinggi akan lebih mudah bereaksi dengan air dan mengeluarkan ion hidrogen atau ion hidroksil, sehingga akan lebih mudah mengalami reaksi asam-basa. Namun, kali kelarutan tidak merupakan satu-satunya faktor yang mempengaruhi reaksi asam-basa. Faktor lain yang juga mempengaruhi reaksi asam-basa adalah kekuatan ionisasi asam atau basa, serta jumlah ion hidrogen atau ion hidroksil yang dapat dikeluarkan oleh zat tersebut saat bereaksi dengan air.
Soal 1
Diketahui reaksi:
Soal 2
Tiga jenis sampel air diambil dari berbagai sumber yang berbeda diuji dengan beberapa indikator dengan hasil percobaan sebagai berikut :
Harga pH untuk air pada sampel 1 dan 2 berturut - turut adalah ?
A. 4 ≤ pH ≤ 6 dan pH ≥ 8
B. pH ≤ 8 dan pH ≥ 7,6
C. 4,2 ≤ pH ≤ 6 dan 7,6 ≤ pH ≤ 8
D. pH ≤ 6,3 dan 6,3 ≤ pH ≤ 8
E. pH ≤ 8,0 dan 7,6 ≤ pH ≤ 8
Soal 3
Terdapat beberapa larutan berikut:
Soal 4
larutan 0,1 M CH3COOH (Ka =10-5 ) . Agar pH larutan menjadi 6 maka larutan itu harus ditambah dengan CH3COONa sebanyak ?
Soal 5
Pasangan larutan berikut yang menghasilkan larutan penyangga adalah ?
Soal 6
Natrium sianida, NaCN dapat dibuat dengan mencampurkan NaOH 5 x 10-3 M dengan 50 mL larutan asam sianida 5 x 10-3 M. Ka HCN =5 x 10-10 . Senyawa tersebut akan terhidrolisis dalam air dengan pH ?
Soal 7
Berikut adalah hasil uji sifat asam / basa dari beberapa garam:
Garam yang mengalami hidrolisis dan sesuai dengan uji lakmusnya adalah ?
Soal 8
Campuran yang menghasilkan garam terhidrolisis sebagian dan bersifat basa adalah ?
Soal 9
Larutan Ca(CN)2 memiliki pH = 11 - log 2. Jika Ka HCN = dan Mr Ca(CN)2 = 92, jumlah Ca(CN)2 yang terlarut dalam 500 mL larutan adalah ?
Soal 10
Sebanyak 3,16 gram(CH3COO)2Ca ,Mr = 158 dilarutkan dalam air hingga volumenya 5 Liter. jika Ka (CH3COO)2Ca = 2 x 10-5, pH larutan yang terjadi adalah ?
Soal 11
Berikut ini data Ksp beberapa senyawa:
Soal 12
Larutan jenuh senyawa hidroksida dari suatu logam,M(OH)3 mempunyai pH = 9. Harga Ksp dari senyawa ini adalah ?
Soal 13
Larutan perak klorida dinyatakan dalam gram/liter larutan pada suhu 25 0C. Ksp AgCl =1,9 x 10-10 (Ar Ag = 108, Cl=35,5) adalah ?
Soal 14
Dalam 100 cm3 air dapat larut 1,16 mg Mg(OH)2 (Mr = 58). Harga Ksp dari Mg(OH)2 adalah ?
Soal 15
Diketahui harga Ksp beberapa senyawa sebagai berikut:
Untuk Melihat Kunci Jawaban Silahkan Kunjungi
Demikianlah artikel tentang Soal Latihan Asam Basa dan Hasil Kali Kelarutan 2, semoga bisa menjadi informasi yang bermanfaat untuk para pembaca setia blog pustaka ilmu. Jangan lupa untuk di share dan berkomentar. Terimakasih
Kali kelarutan adalah ukuran kelarutan suatu zat dalam air pada suhu kamar. Nilai kali kelarutan dapat berkisar dari 0 (tidak larut) hingga bila-bila (larut dalam jumlah tak terbatas). Nilai kali kelarutan yang tinggi menunjukkan bahwa suatu zat dapat larut dalam jumlah yang lebih besar dalam air.
Contoh zat yang bersifat asam adalah asam asetat, asam klorida, dan asam sulfat. Contoh zat yang bersifat basa adalah natrium hidroksida, kalium hidroksida, dan kalsium hidroksida.
Kali kelarutan merupakan salah satu faktor yang mempengaruhi reaksi asam-basa. Zat dengan kali kelarutan yang tinggi akan lebih mudah bereaksi dengan air dan mengeluarkan ion hidrogen atau ion hidroksil, sehingga akan lebih mudah mengalami reaksi asam-basa. Namun, kali kelarutan tidak merupakan satu-satunya faktor yang mempengaruhi reaksi asam-basa. Faktor lain yang juga mempengaruhi reaksi asam-basa adalah kekuatan ionisasi asam atau basa, serta jumlah ion hidrogen atau ion hidroksil yang dapat dikeluarkan oleh zat tersebut saat bereaksi dengan air.
Soal 1
Diketahui reaksi:
- H2PO4- + H2O ↔ HPO42- + H3O+
- A. H2PO4- dan H2O
- B. HPO42- dan H3O+
- C. H2PO4- dan H3O+
- D. HPO42- dan H2O
- E. H2PO4- dan HPO42-
Soal 2
Tiga jenis sampel air diambil dari berbagai sumber yang berbeda diuji dengan beberapa indikator dengan hasil percobaan sebagai berikut :
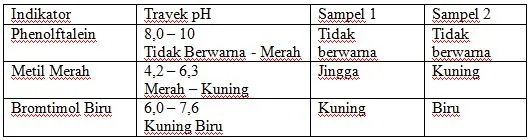 |
| Soal 2 |
A. 4 ≤ pH ≤ 6 dan pH ≥ 8
B. pH ≤ 8 dan pH ≥ 7,6
C. 4,2 ≤ pH ≤ 6 dan 7,6 ≤ pH ≤ 8
D. pH ≤ 6,3 dan 6,3 ≤ pH ≤ 8
E. pH ≤ 8,0 dan 7,6 ≤ pH ≤ 8
Soal 3
Terdapat beberapa larutan berikut:
- 25 mL NaOH 0,1 M
- 25 mL HCN 0,2 M
- 25 mL CH3COOH 0,1 M
- 25 mL NH4OH 0,2 M
- 25 mL HCl 0,2 M
- A. 1 dan 2
- B. 1 dan 3
- C. 2 dan 4
- D. 3 dan 4
- E. 4 dan 5
Soal 4
larutan 0,1 M CH3COOH (Ka =10-5 ) . Agar pH larutan menjadi 6 maka larutan itu harus ditambah dengan CH3COONa sebanyak ?
- A. 0,1 mol
- B. 1 mol
- C. 5 mol
- D. 10 mol
- E. 20 mol
Soal 5
Pasangan larutan berikut yang menghasilkan larutan penyangga adalah ?
- A. 50 mL CH3COOH 0,1 M + 50 mL NaOH 0,25 M
- B. 50 mL CH3COOH 0,1 M + 50 mL HCl 0,1 M
- C. 50 mL HCN 0,05 M + 50 mL NaOH 0,05 M
- D. 50 mL NH4OH 0,1 M + 50 mL HCl 0,05 M
- E. 50 mL NaOH 0,1 M + 50 mL HCl 0,1 M
Soal 6
Natrium sianida, NaCN dapat dibuat dengan mencampurkan NaOH 5 x 10-3 M dengan 50 mL larutan asam sianida 5 x 10-3 M. Ka HCN =5 x 10-10 . Senyawa tersebut akan terhidrolisis dalam air dengan pH ?
- A. 2 - log 1,5
- B. 4 - log 2,2
- C. 10 - log 5
- D. 11 + log 2,2
- E. 12 + log 2,2
Soal 7
Berikut adalah hasil uji sifat asam / basa dari beberapa garam:
 |
| Soal 7 |
- A. 1,2 dan 3
- B. 1,2 dan 4
- C. 2,3 dan 4
- D. 2,3 dan 5
- E. 3,4 dan 5
Soal 8
Campuran yang menghasilkan garam terhidrolisis sebagian dan bersifat basa adalah ?
- A. 50 mL CH3COOH 0,2 M + 50 mL NaOH 0,1 M
- B. 50 mL HCl 0,2 M + 50 mL NH3 0,1 M
- C. 50 mL HCOOH 0,2 M + 50 mL KOH 0,2 M
- D. 50 mL HCl 0,2 M + 50 mL NaOH 0,2 M
- E. 50 mL CH3COOH 0,1 M + 50 mL NH3 0,1 M
Soal 9
Larutan Ca(CN)2 memiliki pH = 11 - log 2. Jika Ka HCN = dan Mr Ca(CN)2 = 92, jumlah Ca(CN)2 yang terlarut dalam 500 mL larutan adalah ?
- A. 0,23 gram
- B. 2,36 gram
- C. 3,45 gram
- D. 4,72 gram
- E. 5,25 gram
Soal 10
Sebanyak 3,16 gram(CH3COO)2Ca ,Mr = 158 dilarutkan dalam air hingga volumenya 5 Liter. jika Ka (CH3COO)2Ca = 2 x 10-5, pH larutan yang terjadi adalah ?
- A. 5 - log 2
- B. 6 - log 2
- C. 8 + log 2
- D. 9 + log 2
- E. 8 + 1/2 log 2
Soal 11
Berikut ini data Ksp beberapa senyawa:
- Mg(OH)2 =7,2 x 10-1
- Mn(OH)2 = 1,6 x 10-13
- Cu(OH)2 = 4,8 x 10-20
- Ca(OH)2 = 6,5 x 10-16
- Zn(OH)2 = 3 x 10-1
- A. 1 dan 2
- B. 1 dan 4
- C. 2 dan 3
- D. 2 dan 4
- E. 3 dan 5
Soal 12
Larutan jenuh senyawa hidroksida dari suatu logam,M(OH)3 mempunyai pH = 9. Harga Ksp dari senyawa ini adalah ?
- A. 3,3 x 10-21
- B. 3 x 10-20
- C. 1 x 10-10
- D. 3 x 10-36
- E. 3,3 x 10-37
Soal 13
Larutan perak klorida dinyatakan dalam gram/liter larutan pada suhu 25 0C. Ksp AgCl =1,9 x 10-10 (Ar Ag = 108, Cl=35,5) adalah ?
- A. 22,9 x 10-4 gram
- B. 20,09 x 10-4 gram
- C.17,22 x 10-4 gram
- D.13,80 x 10-4 gram
- E. 2,09 x 10-4 gram
Soal 14
Dalam 100 cm3 air dapat larut 1,16 mg Mg(OH)2 (Mr = 58). Harga Ksp dari Mg(OH)2 adalah ?
- A.16 x 10-12
- B. 3,2 x 10-11
- C. 8 x 10-11
- D. 4 x 10-10
- E. 8 x 10-8
Soal 15
Diketahui harga Ksp beberapa senyawa sebagai berikut:
- Ksp SrCO3 =1,6 x 10-9
- Ksp MgCO3 =1 x 10-5
- Ksp CaCO3 = 4,8 x 10-7
- A. SrCO3> MgCO3 > CaCO3>
- B. MgCO3 > CaCO3 > SrCO3
- C. SrCO3> CaCO3 > MgCO3
- D. SrCO3> CaCO3 > MgCO3
- E. MgCO3 >SrCO3 > CaCO3
Untuk Melihat Kunci Jawaban Silahkan Kunjungi
Demikianlah artikel tentang Soal Latihan Asam Basa dan Hasil Kali Kelarutan 2, semoga bisa menjadi informasi yang bermanfaat untuk para pembaca setia blog pustaka ilmu. Jangan lupa untuk di share dan berkomentar. Terimakasih

Post a Comment for "Soal Latihan Asam Basa dan Hasil Kali Kelarutan 2"
Post a Comment